《J MED CHEM》:小分子靶向变构位点实现Bcl-2特异性去磷酸化
大连理工大学化工学院化学生物学领域张志超教授团队在化学调控生物大分子的动态修饰方向取得新进展,成果以题为“Targeting the Allosteric Pathway That Interconnects the Core-Functional Scaffold and the Distal Phosphorylation Sites for Specific Dephosphorylation of Bcl-2”发表在Journal of medicinal chemistry 2020, 63, 13733−13744。
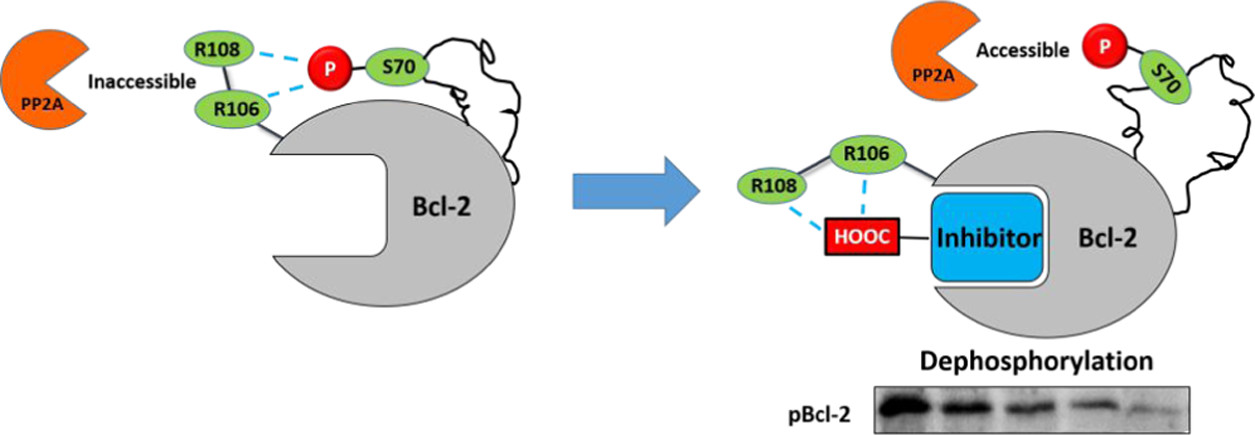
图1. 去磷酸化双功能分子调控Bcl-2磷酸化动态修饰机理示意图。
生物大分子时刻处于修饰位点与种类多变、时空特异和双向可逆的化学修饰的调控之下,如磷酸化、泛素化等。生物大分子的动态化学修饰在生物体的生理活动和病理变化中通常都发挥着关键作用。张志超教授团队多年从事肿瘤靶标的确认和靶向抗癌药的研究工作,一直面临靶标蛋白通过磷酸化修饰重塑肿瘤的分子网络,逃避现有的靶向药物攻击这一难题。其中,最重要的肿瘤靶标之一:Bcl-2蛋白的唯一上市抑制剂Venitoclax也正面临着因Bcl-2磷酸化导致的耐药问题。
在本研究中,通过蛋白质三维核磁、分子动力学计算、结合位点突变等结构生物学、计算生物学和分子生物学方法,解析了磷酸化动态修饰调控Bcl-2的致癌功能分子网络,导致靶向药物耐药的结构基础。研究表明磷酸化修饰的Bcl-2通过磷酸化位点与活性沟槽之间的氢键网络,别构调节活性沟槽,从而影响活性沟槽介导的Bcl-2致癌功能和与靶向抑制剂的结合。在此基础上,将羧酸基团与本课题组自主开发的Bcl-2抑制剂分子巧妙组装,精准阻断了维持Bcl-2磷酸化的磷酸根-精氨酸氢键网络,定点干预了肿瘤靶标蛋白的磷酸化修饰。所获得的去磷酸化分子S1-6e,逆转了肿瘤细胞对上市抗癌药Venitoclax的耐药性,在终于证明磷酸化修饰的Bcl-2蛋白的独立肿瘤靶标地位的同时,获得了集去磷酸化和抑制功能为一体的双功能分子,相比原有抑制剂分子抗癌活性提高了5倍以上,是颇有潜力的抗癌药物先导分子。
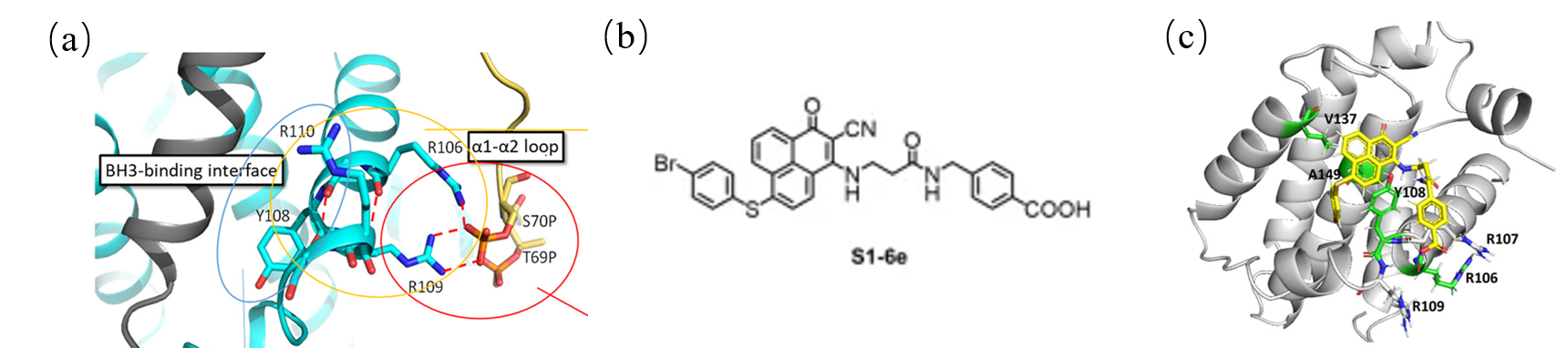
图2. (a)Bcl-2蛋白磷酸化磷酸化位点与活性沟槽之间的氢键网络结构示意图;
(b)去磷酸化双功能分子S1-6e的分子结构;
(c)S1-6e精准阻断维持Bcl-2磷酸化的磷酸根-精氨酸氢键网络。
原文链接:
https://pubs.acs.org/doi/10.1021/acs.jmedchem.0c01290



