《Leukemia》:靶向Hsp70-Bim的小分子抑制剂战胜BCR-ABL非依赖型TKIs耐药的CML
本课题组在Nature旗下医学大类一区top杂志《Leukemia》上发表宋婷副教授的最新研究成果,该论文的题目是"Small-molecule inhibitor targeting the Hsp70-Bim protein–protein interaction in CML cells overcomes BCR-ABL-independent TKI resistance"。《Leukemia》是血液学领域的top3期刊和肿瘤学领域的top9期刊,该杂志作为美国白血病学会的会刊,对研究的深度、完整度和创新性要求非常高,在同类期刊中具有极高的影响力。张志超教授为该篇文章的通讯作者,厦门大学的林东海教授为共同通讯作者,同时感谢其他主要作者对于本篇文章的贡献,包括:郭亚飞、薛祖光、郭宗伟、王紫千、张弘、潘皓、张肖冬、殷方奎、王航、Laura Bonnette Uwituze。
研究内容
靶向BCR-ABL的第1-3代酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)在慢性髓系白血病(CML)患者的临床治疗中遭遇BCR-ABL非依赖型耐药。细胞通过旁路激活等机制逃避最初的抗癌药,升级换代新的TKIs或者与其他化疗药物联合用药也无法解决这一问题。该领域急切需要通过新的思路和研究方法进行新的靶标确认和逆转耐药的抗癌药研发。
Hsp70是一种调控蛋白质稳态的分子伴侣,虽然在肿瘤细胞中大量表达,但是其本身只是肿瘤的“非癌性”依赖,其丰富的生理功能等原因导致其不能作为癌症治疗的靶点。但是,蛋白-蛋白相互作用(PPIs)可能决定了热休克蛋白对底物的特异性识别,可能区分其肿瘤的特异性功能,所以靶向肿瘤特异性Hsp70相关复合物正在成为癌症治疗的研究热点。
张志超课题组在J. Biol. Chem.,2020,295,12900.的研究中揭示了Bcl-2家族成员Bim是Hsp70的辅伴侣蛋白,Hsp70因此是一类含有BH3结构域的非经典BH3受体蛋白。以此为基础,在已建立的Bcl-2抑制剂S1衍生物分子库中,通过体外蛋白亲和力实验筛选获得了能够特异性解离Hsp70/Bim二聚体的小分子抑制剂S1g-2,该分子以亚微摩尔的亲和力结合Hsp70。1H-15N NOESY-HSQC谱图结果发现,S1g-2与Bim结合在Hsp70的同一位点,与已有的Hsp70变构抑制剂MKT-077的结合位点不同。在CML细胞系系K562中,利用生物素化的S1g-2探针分子、生物素化的MKT-077探针分子以及Bim抗体进行连续的免疫共沉淀实验证实,Hsp70/Bim二聚体占总Hsp70蛋白的比例为15%,与S1g-2结合Hsp70的比例相一致,而MKT-077结合细胞中全部的Hsp70蛋白,这说明只有部分Hsp70结合了Bim,而S1g-2也仅仅结合了这一部分Hsp70,不是全部的Hsp70蛋白。
。
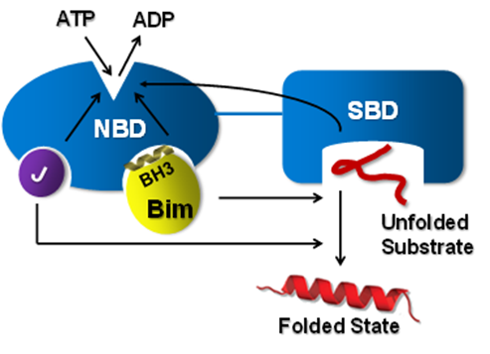
图1. Bim对Hsp70分子伴侣循环调控机制的模式图
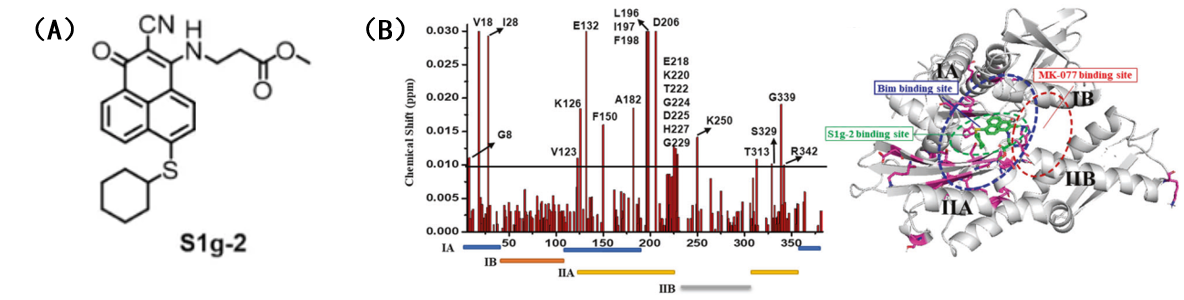
图2. (A)S1g-2的分子式;(B)1H-15N HSQC‐TROSY核磁谱检测S1g-2分子在Hsp70蛋白的结合位置
细胞凋亡实验发现S1g-2诱导CML细胞系和CML患者原始细胞凋亡的能力强于其它肿瘤细胞系和正常白细胞10倍左右,提示Hsp70/Bim二聚体可能是CML的特异性靶标。S1g-2因为其特异性解离Hsp70/Bim成为研究这一问题的小分子工具。
为了验证这个猜想,使用了BCR-ABL转化的BaF3癌变细胞模型。通过免疫共沉淀实验,作者发现BCR-ABL转化的细胞中Hsp70/Bim二聚体水平显著升高,导致其对S1g-2的敏感性明显高于未转化的BaF3细胞,说明BCR-ABL驱动了致癌性Hsp70/Bim二聚体的形成,使之成为特异性的抗癌靶标。
作者进一步使用BCR-ABL非依赖的伊马替尼获得性耐药的CML细胞模型进行研究,结果发现随着耐药指数的梯度升高,Hsp70/Bim的比例越来越高,S1g-2的凋亡诱导活性反倒越来越强。这一表现完全相反于MKT-077和Hsp70的ATP酶抑制剂VER-155008,排除了Hsp70在TKIs作用下单纯通过提高表达水平抑制细胞凋亡。
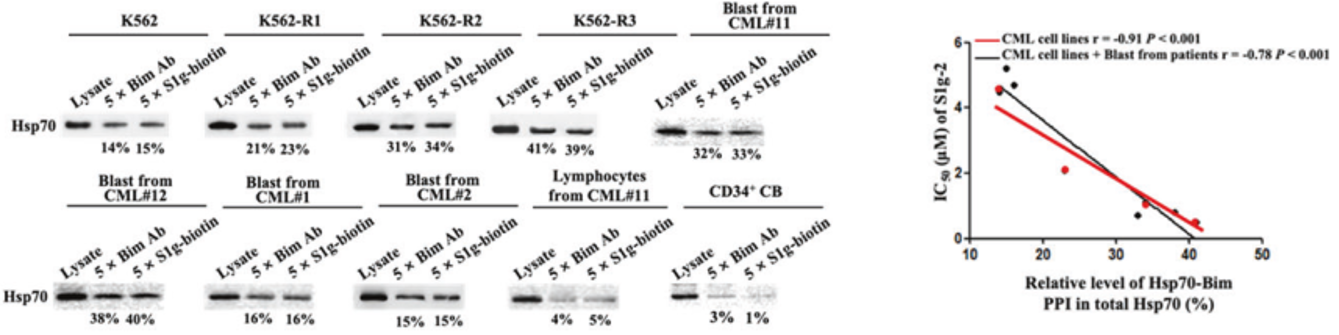
图3. BCR-ABL非依赖型TKIs耐药细胞中的Hsp70/Bim二聚体水平与S1g-2的细胞凋亡诱导活性的相关性分析
那么Hsp70/Bim是如何调控BCR-ABL阳性肿瘤细胞的旁路激活机制?作者在K562细胞中利用免疫共沉淀实验结合蛋白质谱技术,鉴定得到S1g-2干扰的Hsp70互作蛋白质组。IPA通路富集发现,互作蛋白组主要集中在三大通路上:eIF2信号通路,eIF4E和p70S6K通路,以及mTOR信号通路。在BCR-ABL非依赖性TKIs耐药的CML中,Hsp70通过招募Bim作为辅助伴侣蛋白,加强了对通路中的关键节点蛋白AKT, Raf-1和eIF4E的结合和稳定,导致TKIs下调pAKT和pRaf-1的能力越来越弱,CML细胞对TKIs的凋亡逃逸能力越来越强,这是一个新的BCR-ABL阳性肿瘤的旁路激活机制。
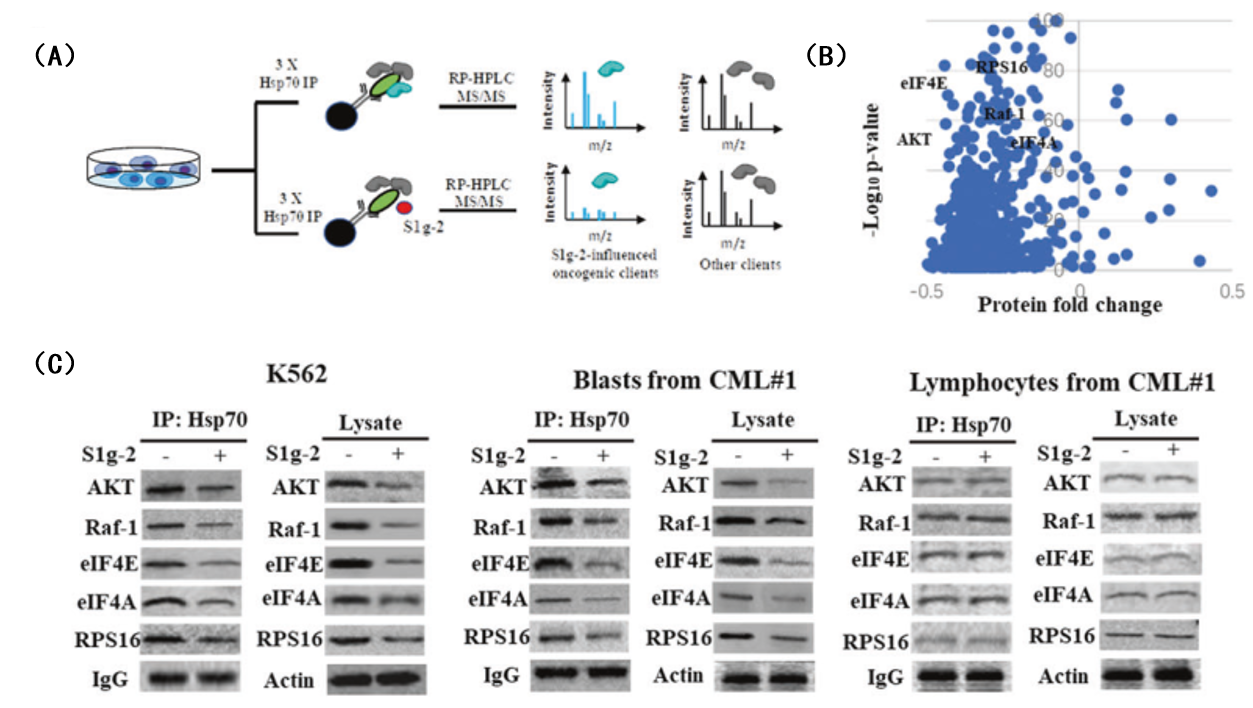
图4. S1g-2对K562细胞和CML患者原始细胞中AKT、Raf-1、eIF4E、eIF4A和RPS16的影响。
(A)基于LC-MS/MS法高通量定量鉴定K562细胞中S1g-2影响的Hsp70互作蛋白质组的流程图;
(B)蛋白质质谱检测到的S1g-2在K562细胞中影响Hsp70抗体富集的蛋白;
(C)通过免疫共沉淀法和免疫印迹法分析加入S1g-2前后AKT、Raf-1、eIF4E、eIF4A和RPS16结合在Hsp70复合体中的蛋白水平及蛋白本底水平。
最后,S1g-2在小鼠移植瘤模型中的体内抗CML的活性表明这个小分子具有选择性、高效、低毒抗CML的功能。
总之,该工作确定了Hsp70/Bim二聚体是CML的特异性靶点和逆转BCR-ABL非依赖TKIs耐药的靶点,首个Hsp70/Bim抑制剂S1g-2成为治疗CML的新的抗癌候选药物。该工作为靶标确认—抗癌药研发—分子标志物鉴定一体化研究提供了一个成功的例子。
DOI:
10.1038/s41375-021-01283-5
文章链接:https://doi.org/10.1038/s41375-021-01283-5



