《J MED CHEM》:基于非选择性配体设计合成的PROTAC分子 选择性降解Mcl-1/Bcl-2蛋白
靶标占据型小分子抑制剂必须长时间、高比例的占据疾病相关靶标蛋白的活性位点,才能有效抑制靶标蛋白的活性和疾病的发生发展。这种苛刻的条件导致小分子抑制剂通常需要在体外实验中表现出与靶标蛋白nM甚至pM级别的亲和力才能够有效在活细胞内和活体内有效抑制疾病的发生发展。而蛋白-蛋白相互作用(PPI)具有作用界面面积大、疏水性差的特点,不利于化学小分子的结合。此外,同一PPI家族的多种同源蛋白,其PPI作用界面具有很高的序列和结构相似性,不利于选择性抑制剂的设计。因此,难以获得高达nM级别亲和力、高选择性和具有良好生物学活性的抑制剂分子,是目前PPI抑制剂领域发展的瓶颈所在。
Proteolysis Targeting Chimeras (PROTACs)分子是一种通过在靶标蛋白抑制剂上通过连接基团耦联一个泛素化E3连接酶结合基团获得的多功能分子。PROTAC分子通过与靶标蛋白、泛素化E3连接酶形成三者复合物,促进靶标蛋白的泛素化和降解,在活细胞/活体内实现对靶标蛋白的“化学敲低”(chemical knock down)。PROTAC分子在这一过程中不被消耗,可以在靶标蛋白被降解后游离出来被反复利用。因此,只需要催化计量的PROTAC分子就可以对靶标蛋白水平进行有效的敲低,因此PROTAC分子可以克服靶标占据型抑制剂需要高亲和力、长时间、大剂量占据靶标蛋白的难题。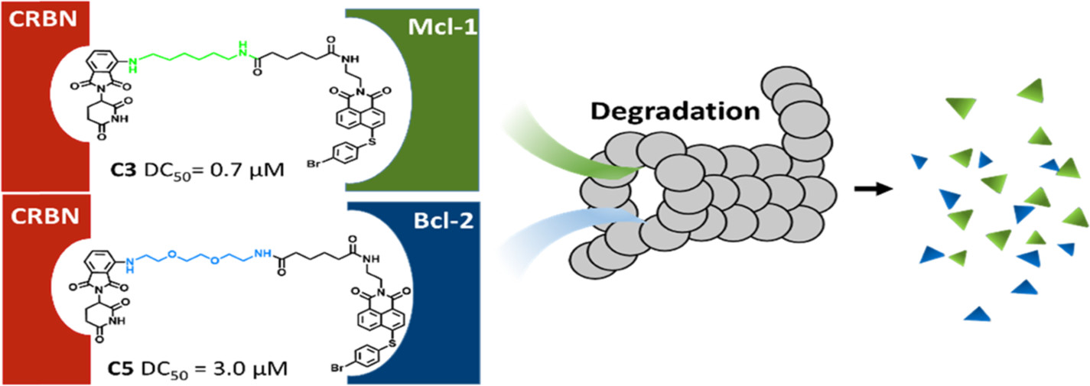
本课题组王紫千博士等人最近通过将E3连接酶结合基团CRBN利用不同长度、空间构象的连接基团耦联到本课题组已经发表的一个μM级别体外亲和力、非选择性的Bcl-2家族蛋白PPI抑制剂上,设计、合成、筛选出了具有选择性“化学敲低”Bcl-2家族关键肿瘤靶标相关蛋白Bcl-2和Mcl-1的PROTAC分子。这两个分子选择性地促进靶标蛋白降解,具有超越传统靶标占据型抑制剂小分子,作用于Bcl-2/Mcl-1靶标的更强的抗肿瘤活性。 该项研究成果目前已被药物化学类顶级期刊《J. Med. Chem.》(IF:6.2) 录用。
具体文章详见原文链接:



